As diferentes pilhas que encontramos no mercado têm todas o mesmo princípio de funcionamento: transformam energia química em elétrica, por meio de reações com transferência de elétrons.
A pilha também é denominada célula galvânica e fornece energia ao sistema somente até que a reação química se esgote.
Seu funcionamento se baseia em transferência de elétrons de um
metal que tem a tendência de ceder elétrons para um que tem a tendência
de ganhar elétrons, ou seja, ocorrem reações de oxidorredução. Essa
transferência é feita por meio de um fio condutor.
Para entendermos como isso se dá, vejamos a reação de oxidorredução que
ocorre entre o zinco e o cobre e como isso pode ser utilizado para
gerar uma pilha:
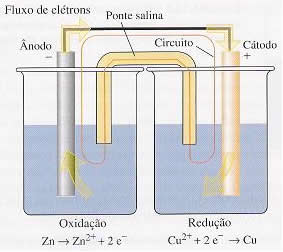
Se colocarmos uma placa de zinco em uma solução de sulfato de zinco (ZnSO4), estaremos constituindo um eletrodo de zinco. Da mesma maneira, se colocarmos uma placa de cobre em uma solução de sulfato de cobre (CuSO4), teremos um eletrodo de cobre.
Como o zinco é mais reativo que o cobre, ele tem a tendência de doar
elétrons para o cobre. Assim, se ligarmos esses dois eletrodos por meio
de um fio condutor externo, ocorrerá a transferência dos elétrons e
consequentemente a passagem de corrente elétrica. Isso é visível, pois,
depois de um tempo, notamos que a lâmina de cobre teve um aumento em sua
massa, enquanto que a de zinco sofreu corrosão.
Os elétrons, por apresentarem carga negativa, migram do eletrodo negativo, denominado ânodo; para o positivo, que recebe o nome de cátodo Assim, temos a reação global dessa pilha em particular:
Semirreação do ânodo: Zn (s) → Zn2+ (aq) + 2 e-
Semirreação do cátodo: Cu2+(aq) + 2e- →Cu(s)___________
Reação global da pilha: Zn (s) + Cu2+(aq)→ Zn2+ (aq) + Cu(s)
Semirreação do cátodo: Cu2+(aq) + 2e- →Cu(s)___________
Reação global da pilha: Zn (s) + Cu2+(aq)→ Zn2+ (aq) + Cu(s)
A notação química correta de uma pilha baseia-se na seguinte regra por convenção mundial:
Ânodo // Cátodo
Oxidação // redução
Oxidação // redução
Assim, nesse casso, temos:
Zn / Zn2+ // Cu2+ //Cu(s)
Isso mostra que esse dispositivo é uma pilha, pois a partir de uma reação espontânea de oxidorredução ele produziu corrente elétrica. Essa pilha é chamada de Pilha de Daniell, por ter sido construída em 1836, pelo químico e meteorologista inglês John Frederic Daniell (1790-1845).
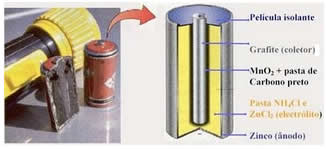
Hoje existe uma diversidade de pilhas que podem variar em diferentes aspectos. Porém, as pilhas mais comuns são as secas,
que não utilizam soluções aquosas como as da Pilha de Daniell; mas que
funcionam baseadas no mesmo princípio: a transferência de elétrons do
ânodo para o cátodo. A seguir temos a representação esquemática da
composição de uma pilha seca ácida:


















0 comentários:
Postar um comentário
Deixe seus comentário ou faça alguma sugestão nesse blog.